关于抑郁症可能的发病机制调查研究
上一篇关于快速抗抑郁的药物研究进展中,一共引用了138篇期刊,总字数飙升到了1w5k多字,其实正文内容还好,占了大篇幅的,是那些专有名词的解释说明,每一段中不懂的内容都得找论文,尝试理解,这个是什么东西,在哪,怎么作用的,然后将解释和引用都写下来了。那么既然这篇博客的标题已经确定了,是讨论抑郁症的发病机制,那么我就不需要再长篇大论了,而是根据几个方面,进行调查研究即可,话不多说,让我们开始吧。
摘要
抑郁症的发病机制可能涉及多个因素:
神经递质的改变:抑郁症患者的生物胺类神经递质(如儿茶酚胺和5-羟色胺)的代谢可能发生改变,这可能与自主神经系统的调节失衡有关[1]。
能量代谢紊乱:一些研究发现,抑郁症患者的能量代谢可能受到影响,例如三羧酸循环(TCA)显著降低,而糖异生途径异常增加。这可能与线粒体功能障碍有关,影响了能量代谢的底物供应。
大脑结构的改变:抑郁症可能导致大脑的一些结构性改变,包括炎症和萎缩。这些改变可能影响到情绪的感知和调节[2]。
肠道菌群的改变:肠道菌群的代谢产物可能影响抑郁症的发生,这些产物具有神经活性和免疫调节性质 [3]。
奖赏回路的改变:抑郁症患者的脑内奖赏回路可能发生改变,这可能与抑郁症的主要症状如无快感、动机减退和能量水平降低有关[4]。
在这篇博客中,有关能量代谢的内容会多提及一些,笔者会多进行一些调查研究,来尝试说明有关这个因素的发病机制是什么
三羧酸循环(TCA)是生物体内的一种重要的代谢途径,也被称为柠檬酸循环或克雷布斯循环。它是碳水化合物、脂肪和氨基酸氧化的最终通用途径,是体内能量供应的最重要的代谢途径。TCA循环连接了几乎所有的单个代谢途径,包括有机酸的合成,如柠檬酸、α-酮戊二酸、琥珀酸、延胡索酸、L-苹果酸和草酰乙酸等。这些有机酸是广泛应用的基础化学品,具有巨大的市场[5]。
详细说明
神经递质
抑郁症的发病机制可能与大脑中的神经递质有关。主要的单胺神经递质,包括多巴胺、去甲肾上腺素和5-羟色胺,与抑郁症的特定症状存在关联。这些神经递质的增加或减少可能与抑郁症的特定症状有关,这表明抑郁症的特定症状可能被归因于特定的神经化学机制,因此特定的抗抑郁药物可以针对症状特异性的神经递质[6]。此外,一些非单胺神经递质,如一氧化氮和内源性大麻素,也在抑郁症的神经生物学和抗抑郁作用中起着重要作用[7]。γ-氨基丁酸(GABA)是哺乳动物中枢神经系统的主要抑制性神经递质,也与抑郁症有关。研究表明,抑郁症与大脑GABA的缺乏有关[8]。另一项研究发现,与健康对照组相比,抑郁症患者的GABA水平显著降低 [9]。此外,叶酸缺乏在抑郁症患者中也相对常见,大约三分之一的抑郁症患者存在明显的缺乏。叶酸是合成单胺神经递质血清素、肾上腺素和多巴胺所必需的水溶性B族维生素 [10]。然而,尽管抗抑郁药物通过提高这些神经递质的水平来缓解抑郁症症状,但目前尚未找到确凿的证据表明抑郁症患者的特定单胺系统存在主要功能障碍[11]。
内源性大麻素系统是一种广泛的脂质信号系统,它在所有脊椎动物体内具有重要的调节功能。主要的内源性大麻素(内源性类大麻物质)是从花生四烯酸衍生的小分子,包括阿拉基酰乙醇胺(anandamide)和2-花生四烯酸甘油酯(2-arachidonoylglycerol)。它们与一系列G蛋白偶联受体结合,其中大麻素CB(1)受体在与运动控制、认知、情绪反应、有动机的行为和稳态相关的大脑区域中分布密集。在大脑之外,内源性大麻素系统是自主神经系统、免疫系统和微循环的关键调节器之一。内源性大麻素在受体依赖的方式下从脂质前体中释放,并作为GABA能和谷氨酸能突触的逆向信号信使,以及与其他神经递质(包括多巴胺)交互的突触后传输调节器[12]。
能量代谢紊乱
抑郁症的发病机制可能与能量代谢紊乱有关,一些研究发现:
- 抑郁症患者的三羧酸循环(TCA)显著下降,而糖异生途径异常增加,这可能是能量代谢紊乱的关键酶,包括丙酮酸脱氢酶(PDH)和丙酮酸羧化酶(PC)[13]。
- 抑郁症患者的线粒体功能可能受损,导致能量代谢底物供应紊乱,例如线粒体丙酮酸载体(MPC)的水平显著降低,这对丙酮酸进入TCA循环至关重要[13]。
- 抑郁症患者的氨基酸代谢、能量代谢和脂质代谢可能受到影响 [14][15]。
- 抑郁症与肥胖症的生物学联系也可能涉及能量代谢的调节,例如,肥胖相关的瘦素信号紊乱可能影响情绪[16][17]。
- 抑郁症患者的总能量消耗和活动能量消耗在24小时内显著降低,而且随着抑郁症症状的缓解,他们的身体活动参数显著增加[18]。
抑郁症患者的能量代谢可能受损,这可能是抑郁症发病的重要机制之一[19]。
这些研究结果表明,抑郁症患者的身体活动水平和能量消耗可能会降低,这可能与抑郁症的发病机制有关,能量代谢紊乱可能是抑郁症发病机制的重要组成部分。
线粒体丙酮酸载体(Mitochondrial acetoacetyl-CoA thiolase,也被称为T2)是一种酶,它在体内的异亮氨酸和酮体的代谢过程中起着重要的作用。T2的缺乏会导致一种罕见的常染色体隐性遗传疾病,影响异亮氨酸和酮体的代谢。这种疾病的特征是反复发生的酮症酸中毒,开始时会有呕吐,然后会出现脱水和呼吸急促。在稳定的条件下,T2缺乏症患者的尿液有机酸和血液酰肉碱剖面可能存在微妙的异常[20]
抑郁症患者的能量代谢受损可能会导致多种身体症状。例如,他们可能会出现体重增加、食欲增加、过度睡眠、疲劳、肌肉麻痹、缺乏能量、注意力集中问题等症状,这些症状可能部分地由于线粒体功能受损导致的三磷酸腺苷(ATP)供应减少而引起[21],反映了能量摄取/消耗平衡的改变。
此外,抑郁症患者可能会出现无快感症,这是一种对原本乐于参与的活动失去兴趣的症状,这可能与大脑中线粒体呼吸链和肌酸激酶活动的改变有关。
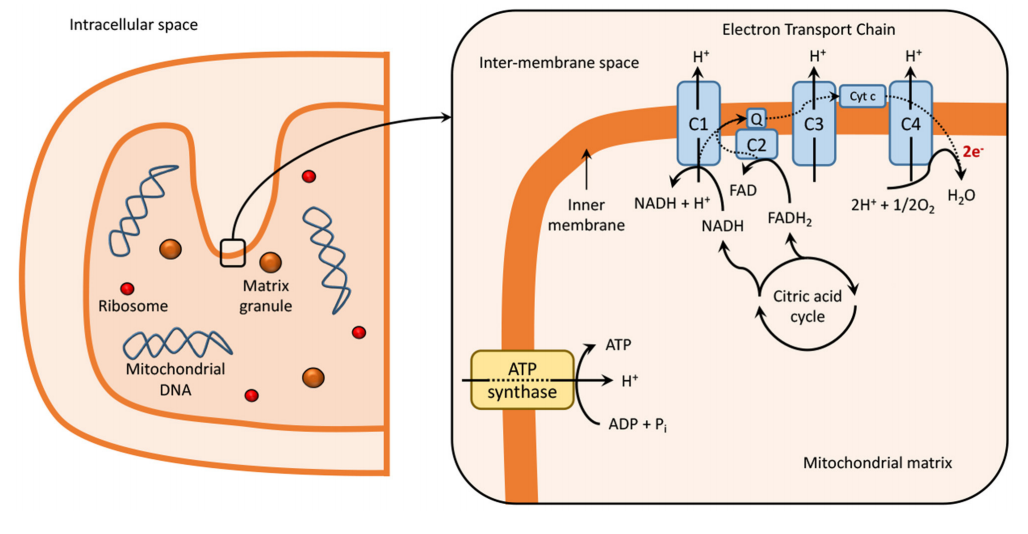
线粒体呼吸链是线粒体氧化磷酸化系统的核心部分,对细胞代谢起着中心作用。它由五个酶复合物和两个移动电子载体组成,通过将进入线粒体的还原当量的氧化与质子梯度的产生和随后的消散相耦合,驱动ATP的产生,ATP随后被用作几乎所有细胞过程的主要能量载体。这五个酶复合物包括NADH-泛醌氧化还原酶(复合物I)、琥珀酸脱氢酶(复合物II)、泛醌-细胞色素c氧化还原酶(复合物III)、细胞色素c氧化酶(复合物IV)和ATP合酶。这些复合物通过催化NADH和琥珀酸的氧化以及氧的还原为水的电子转移途径,形成线粒体内膜上的质子和电荷梯度,该梯度被用来驱动ATP的合成 [22][23][24]
肌酸激酶(CK)是一种酶,它在体内的能量代谢过程中起着关键作用。CK能够迅速为需要大量能量的过程提供三磷酸腺苷(ATP),包括心血管收缩等。CK可以分解为三个独立的部分:CK-1主要存在于大脑和肺部,CK-2主要存在于心脏,CK-3存在于骨骼肌。当这些身体部位因受伤或疾病而受损时,CK酶可以被释放到血液中。通过血液测试可以测量CK的活动,这有助于医生识别身体受损的区域[25]。
体重变化和食欲变化
抑郁症患者可能会出现食欲和体重的变化,部分人群存在体重增加的风险。体重增加的途径可能包括食欲紊乱、过度进食和食欲激素的失调[26]。研究发现,女性抑郁症患者中食欲/体重增加的人群,瘦素(一种饱腹激素)水平较高[27]。此外,抑郁症患者中有较高比例的人满足食物成瘾的标准,这可能与多巴胺(一种与食物摄入有关的神经递质)有关[28]。然而,这些研究结果并不能确定激素因素在抑郁症过度进食中的因果作用,需要进一步的纵向研究来更好地理解这一问题。
过度睡眠和疲劳
抑郁症患者常常会出现过度睡眠和疲劳的症状。研究发现,睡眠质量(如夜间醒来次数)和白天嗜睡症是疲劳严重程度的重要预测因素[29]。此外,使用镇静抗抑郁药物治疗可以显著改善抑郁症患者的嗜睡症和疲劳症状[30]。然而,疲劳和过度睡眠的症状在抑郁症治疗后常常会残留,因此可能需要特定的治疗方法来解决这些症状[31]。在一般人群中,疲劳与抑郁症的关联独立于过度白天嗜睡症[32]。
肌肉麻痹和缺乏能量
抑郁症和肌肉麻痹或缺乏能量之间可能存在一些联系。抑郁症患者可能会感到极度疲倦,即使在良好的睡眠后也是如此。他们可能会有睡眠问题,可能睡眠过多或根本无法入睡,这可能导致精疲力竭[33]。此外,抑郁症患者可能会出现肌肉疲劳,这是一种症状,会随着时间的推移降低肌肉的表现能力,使人感到更弱 [34]。此外,一项研究发现,握力较弱的人更可能患有抑郁症[35]。然而,这些症状也可能是其他疾病的表现,例如慢性疲劳综合症或肌无力症 [36]。因此,如果您有这些症状,应寻求医生的帮助以确定确切的原因。
注意力集中问题
抑郁症患者常常抱怨注意力集中的问题,这些问题对他们的日常功能产生了负面影响[37]。这些问题通常表现为选择性、持续性和分散性注意力的行为障碍[37]。研究发现,抑郁症患者在阅读和看电视时最常出现注意力问题,这些问题往往与彼此高度相关[38]。此外,抑郁症患者的注意力问题可能常常是由于“心神不宁”引起的[39]。
抑郁症患者的注意力问题可能与大脑中负责认知的网络的异常有关[37]。例如,患者可能会出现“心神不宁”或“一片空白”的现象,这两种现象在不同的任务性能相关性上有所不同[40]。此外,抑郁症的严重程度也可能影响注意力问题的严重程度[41]。
目前的一线治疗方法并不能缓解抑郁症患者的注意力问题[37]。因此,更有针对性的药物、脑刺激和行为干预可能是更有效的治疗方法[37]。
无快感症
无快感症是抑郁症的核心症状之一,定义为失去兴趣或快感的状态 [42]。无快感症在抑郁症和精神分裂症等精神疾病中都有出现,与大脑奖赏和厌恶功能的缺陷有关 [43]。在慢性抑郁症患者中,无快感症的程度与抑郁的严重程度无关,即使抑郁症状显著减轻,无快感症的程度也可能保持不变[44]。此外,无快感症也可能在使用选择性5-羟色胺再摄取抑制剂(SSRI)的抑郁症患者中持续存在[45]。药物治疗,包括使用美拉托宁类药物(如阿哥美拉汀)、单胺类药物(如氟西汀、舍曲林等)、谷氨酸类药物(如氨甲环酸、利鲁唑等)、兴奋剂(如甲基苯丙胺)和致幻剂(如麦角酸二乙胺),可能对无快感症有所帮助[46]。然而,对无快感症的治疗仍需要进一步的研究。
托宁类药物是一种存在已久的药物,自20世纪初至70年代非常流行,主要用于治疗睡眠问题和焦虑。托宁类药物对大脑有抑制作用,它们增加了伽马氨酪酸(GABA)的活性,这是一种产生镇静效果的大脑化学物质。它们可以产生短期到长期的效果,具体取决于特定的药物。托宁类药物会形成习惯,你可能会对它们产生耐受性和依赖性,这意味着你需要更大的剂量才能获得相同的效果。此外,突然停止使用这类药物会引起戒断症状。过量使用托宁类药物是危险的,这是现在这些药物不再被广泛开处方的原因之一[47]。
大脑结构
抑郁症可能会导致大脑结构的一些变化。这些变化可能包括炎症和实际的萎缩,特定大脑区域的大小可能在经历抑郁症的人中减小,这种萎缩可能是可逆的[48]。受影响的个体可能会表现出如杏仁核、海马和基底节等结构的体积减小,以及大脑中神经递质水平的改变[49]。
抑郁症患者的海马体积减小可能特定于海马的某些亚区,这与海马神经可塑性的局部机制一致[50]。此外,抑郁症患者的大脑可能表现出比实际年龄更高的“大脑年龄”,但这种差异似乎不受特定临床特征(如复发状态、缓解状态、抗抑郁药物使用、发病年龄或症状严重程度)的驱动[51]。
\研究发现,抑郁症的严重程度与背内侧前扣带皮质(ACC)的厚度负相关,表明抑郁症和ACC厚度的减少之间存在剂量-反应关系[52]。抑郁症患者的大脑可能会出现白质微结构的改变[53]。然而,这些大脑结构的改变可能与抑郁症的状态有关,只在抑郁症的急性发作期出现,而在缓解后恢复正常[54]。
肠道菌群
肠道菌群在抑郁症的发病机制中起着重要的作用。研究发现,抑郁症患者的肠道菌群与健康人存在显著差异,抑郁症患者的肠道菌群多样性和丰度较低 [55]。肠道菌群可以通过神经、免疫、内分泌和代谢途径影响中枢神经系统,这被称为“菌群-肠-脑轴”[56]。
肠道菌群还能影响神经递质的产生,例如,研究发现,抑郁症小鼠的肠道菌群改变与神经递质和短链脂肪酸的变化有关[57]。因此,肠道菌群可能通过影响神经递质的调节,进而影响情绪和行为,导致抑郁症的发生[58]。这为开发新的治疗策略提供了可能,例如使用益生菌和益生元来调节肠道菌群,改善抑郁症症状 [57] [55][56][58][59]。
短链脂肪酸(SCFAs)主要由肠道微生物群发酵膳食纤维产生,也可以由皮肤和阴道的细菌产生。主要的短链脂肪酸包括醋酸,丙酸和丁酸,它们的生物活性已被广泛研究。短链脂肪酸具有许多健康益处,如抗炎,免疫调节,抗肥胖,抗糖尿病,抗癌,心血管保护,肝脏保护和神经保护活动。短链脂肪酸的两个主要信号机制已被确定,即抑制组蛋白去乙酰化酶(HDACs)和激活G蛋白偶联受体(GPCRs)。由于HDACs调节基因表达,抑制HDACs具有广泛的下游影响。GPCRs,特别是GPR43,GPR41和GPR109A,已被确定为SCFAs的受体。研究表明,这些GPCRs在代谢,炎症和疾病的调节中起着主要作用。短链脂肪酸已被证明可以改变趋化性和吞噬作用;诱导活性氧(ROS);改变细胞增殖和功能;具有抗炎,抗肿瘤和抗微生物效果;并改变肠道完整性。这些发现强调了短链脂肪酸在维持肠道和免疫稳态中的作用。鉴于短链脂肪酸的广泛影响,以及它们的水平受饮食调节,它们为解释西方国家炎症性疾病的增加提供了新的依据。[60][61][62]
奖赏回路
奖赏回路在抑郁症中起着重要的作用。抑郁症的核心症状之一是无法从以前的奖赏刺激中获得快乐,这可能反映了奖赏处理中的基础调节失常[63]。奖赏回路的主要部分是脑的中脑边缘多巴胺系统,包括伏隔区和腹侧被盖区,这两个区域在抑郁症的病理生理和症状表现中起着重要的作用[64]。此外,研究还发现,抑郁症患者的奖赏回路中的一些转录因子(如CREB,ΔFosB,SRF,NFκB和β-连环蛋白)发生了改变,这些改变在动物模型中产生了强烈的抑郁症或抗抑郁症效应[65]。此外,研究还发现,抑郁症患者的奖赏回路功能可能受到炎症的影响,例如,血浆中的白细胞介素6(IL-6)和肿瘤坏死因子α的增加可能影响皮质纹状体奖赏回路。总的来说,奖赏回路在抑郁症的发生和发展中起着关键的作用。
中脑边缘多巴胺系统(Mesolimbic Dopaminergic System)是大脑中的一个重要神经系统,它起源于脑的腹侧被盖区(Ventral Tegmental Area,VTA),并向前脑的多个区域投射,包括一个主要的终止区域,即伏隔核(Nucleus Accumbens,NAc)。这个系统在调节动机行为,如奖赏和学习等方面起着核心作用。例如,当你做了一些好的或愉快的事情时,你的大脑会被多巴胺充满,这会鼓励你再次采取这个行动[66]。此外,中脑边缘多巴胺系统也在睡眠/觉醒调节、食物摄取的强化、抑郁症的奖赏回路、疼痛和相关的情感共病症等方面发挥作用 [67][68][69][70]。
额外补充
抑郁症和遗传学的关系
抑郁症是一种复杂的疾病,其发病机制可能涉及遗传和环境因素的相互作用。研究表明,抑郁症有一定的遗传倾向。例如,如果你的直系亲属有抑郁症,你可能有更高的患病风险 [71][72]。一项对五个家庭研究的元分析发现,主要抑郁症的遗传率为37% [73]。然而,抑郁症的遗传机制并不简单,可能涉及多个基因的作用。一些人的大脑在抑郁症时会有明显的变化,这可能与大脑功能的开始有关。特定的神经递质(如血清素、多巴胺和去甲肾上腺素)可能在抑郁症患者中失衡 [71]。此外,性别也可能影响抑郁症的遗传关联,女性比男性更容易受到抑郁症的影响[74]。然而,尽管遗传因素在抑郁症的发病中起着重要作用,但我们对其具体机制的理解仍然有限[75]。
抑郁症和生理学的关系
抑郁症与生理学的关系涉及到多种生物化学和神经生理学因素。首先,抑郁症的典型症状,如体重减轻、性欲变化、月经不调和睡眠障碍,可能反映出生物化学和神经生理功能的主要紊乱,这些症状通常不会在其他心理障碍中出现[76]。此外,抑郁症与心脏病的关系可能涉及到下丘脑-垂体-肾上腺轴的失调、心率变异性的降低、血小板功能的改变以及免疫功能的损害[77][78]。抑郁症还与慢性疼痛有关,可能涉及到神经塑性、炎症、氧化应激、内分泌系统的改变等生物学机制[79]。此外,生活方式因素,如饮食、睡眠和运动,也可能影响与抑郁症相关的生理过程[80][81]。
抑郁症和生物学的关系
抑郁症是一种复杂的疾病,涉及到生物学和心理社会因素的相互作用。在生物学层面,抑郁症与神经递质(例如,去甲肾上腺素,5-羟色胺,多巴胺)的代谢有关,这些神经递质在大脑中影响幸福和快乐的感觉,可能在抑郁症患者中失衡[76]。此外,抑郁症可能与脑功能的显著变化有关,包括脑区体积的减小和活动的改变[2]。慢性炎症也可能与抑郁症的症状有关,特别是在癌症患者中[82]。此外,抑郁症还与激素生产或功能的变化有关,这可能导致抑郁状态的发生[71]。总的来说,抑郁症的生物学机制涉及到神经递质的失衡,脑功能的改变,慢性炎症以及激素的变化。
论文精读
时间紊乱和抑郁症
这篇是 Effects of chronotype on antidepressant treatment and symptoms in patients with depression: a multicenter, parallel, controlled study,我翻译为 时间类型对抑郁症患者抗抑郁治疗和症状的影响:一项多中心、平行的对照研究
摘要
目的
分析抑郁症患者治疗前后时间型的变化,探讨不同时间型对抗抑郁治疗的影响以及抑郁症患者常见症状的维度。
方法
选取浙江省10家三级精神病医院180例抑郁症患者,根据早晚问卷(MEQ)评分,将患者分为三组:早期型组、中期型组和晚期型组 。 17 项汉密尔顿抑郁量表 (HAMD-17)、汉密尔顿焦虑量表焦虑量表 (HAMA)、斯奈思汉密尔顿愉悦量表 (SHAPS)、多维疲劳量表 20 (MFI-20) 和匹兹堡睡眠质量指数 (PSQI) 分别在基线和第2、4、8、12周结束时进行测量,采用重复测量的方差分析来分析研究中各指标的变化。 对各时间点抑郁症缓解率进行统计分析。
结果
在该研究纳入的 180 名患者中,有 26 名患者失访,最终有 154 名患者纳入分析。 基线时,分别有14.93%、56.5%和28.57%的受试者被诊断为中晚期型、中晚期型和早晚期型,早期型组的Shaps和MFI-20总分较高 高于晚期型组和中期型组(p<0.05)。 在12周抗抑郁治疗期间,PSQI、Shaps、MFI-20和MEQ的时间效应与不同时间组存在交互作用(p<0.05)。 治疗过程中抑郁症多个症状维度均有不同程度改善,但变化趋势不尽相同,且快感缺乏恢复明显延迟,早期型患者存在快感缺失等多种症状 和睡眠障碍。 不同时间类型对抑郁症缓解率无显着影响(p>0.05)。
结论
睡眠时间型紊乱在抑郁症患者中很常见。 不同时间类型对抑郁症不同症状维度的时间效应有所影响,但对抑郁症缓解率影响不显着。 加强抑郁症患者生物钟的管理可能对抑郁症的治疗具有重要意义。
关键词
抑郁症、生物节律、时间型、快感缺乏、抗抑郁治疗
介绍
抑郁症是当今社会最常见、最重要的精神疾病之一。 抑郁症的临床特征是显着且持续的兴趣丧失或情绪抑郁,并伴有认知、行为、生理和身体障碍。 抑郁症是全球第三大残疾原因,患病率为 10-77%。 抑郁症不仅是一种严重的精神疾病,它对身体的危害也很大。 10%的抑郁症患者的临床结局是自杀,这不仅给自己造成不可挽回的伤害,也给家人和朋友带来很大的影响。 此外,研究表明,抑郁症的存在与脑血管疾病、心血管疾病和糖尿病的发病率和死亡率增加有关。 尽管对抑郁症发病机制的研究表明其与遗传学、生理学或生物学有关,但抗抑郁治疗效果的研究却鲜有进展。
昼夜节律,又称近日节律,是指生命活动以24h左右为一个周期变化,昼夜交替,人体生理功能出现相应的周期性变化,在学习和生活中也存在明显的昼夜波动。 记忆能力、情绪和工作效率。 初步研究表明,生物节律尤其是昼夜节律与抑郁症的发病、症状特征、合并症、预后、复发和社会功能密切相关。 在昼夜节律紊乱的指标中,生物钟反映了个人对日常活动和觉醒(早上或晚上)的特征偏好。 根据个体在24小时日常生活中的时间偏好和组织自身活动的倾向,昼夜节律的时间型可以分为三种不同的类型:早期型、中期型和晚期型。 据报道,晚时型定义了晚睡和活动习惯的明显倾向,它与情绪障碍患者的昼夜节律相位延迟有关,并且无论睡眠质量和结构如何,它可能与情绪调节独立相关。 。
睡眠时间型紊乱在抑郁症患者中普遍存在,是抑郁症的重要临床特征和病理生理机制,约一半的抑郁症患者存在明显的昼夜节律改变。
由于对抑郁症睡眠型紊乱的关注较晚,临床实践中缺乏对睡眠型睡眠障碍的生物学特征及其干预的关注。 尽管昼夜节律系统与抑郁症之间的联系已得到充分证实,但时间型障碍与抑郁症之间的生物学关系还远未了解,本研究是与几家大型三级精神病医院联合开展的一项多中心、平行对照研究,旨在 探讨三种不同时间类型对抑郁症治疗的影响,以期为抑郁症的临床治疗提供新的证据和见解。
材料和方法
一般信息
研究对象选自2019年3月1日至2019年6月30日浙江省10家精神病医院。 以纳入标准和排除标准为参考,通过固定数量的连续竞争性入组,共纳入180例患者。 研究结束时,有26名患者因脱落或数据不完整而被排除在分析之外,最终纳入154名患者,其中男性45名,女性109名。
纳入标准:
- (1)符合国际疾病分类第十版(ICD-10)抑郁发作诊断标准的抑郁症患者
- (2)采用MINI-国际神经精神访谈(MINI)中文版进行诊断筛查
- (3)急性抑郁发作患者,HAMD-17≥17,临床总体印象-严重度(CGI-S)≥3; 首次发作或复发均可,2周前未接受抗抑郁治疗且未接受抽搐等物理治疗
- (4)所有患者均服用抗抑郁药物6个月以上
- (5)汉族; 性别不限,年龄18-65周岁; (6)签署知情同意书。
排除标准:
- (1)分裂情感性精神病、心境恶劣或双相抑郁; 1年内以任何其他焦虑症为主要诊断; 物质依赖; 人格障碍;
- (2)停用抗抑郁药或改变用药方案
- (3)乙型肝炎病毒或丙型肝炎病毒携带者/患者; 肝功能异常、肝硬化或活动性肝病患者; 3)患有严重心、脑、肾、内分泌器官疾病或其他严重躯体疾病的患者
- (4)既往对标准阿戈美拉汀治疗无效,或本次发作时使用≥2种抗抑郁药充分治疗无效者
- (5)抑郁发作持续2年以上
- (6)有明显的自杀企图或行为,且HAMD第3项(自杀项RRB-评分≥3;7)哺乳期、妊娠期或试验期间需要或无法使用安全有效避孕的女性。
本研究经湖州市第三人民医院伦理委员会批准并实施(伦理号:2019伦理审查第028号)。 所有患者均签署知情同意书。
学习规划
这是一项观察性研究。 收集了分析中 154 名患者的人口统计特征和临床数据,包括年龄、性别、体重指数 (BMI) 以及是否患有首发抑郁症。 早晚问卷 (MEQ)、汉密尔顿抑郁量表 (HAMD-17)、汉密尔顿焦虑评定量表 (HAMA)、斯奈思汉密尔顿愉悦量表 (SHAPS)、多维疲劳量表 (MFI-20) 和匹兹堡睡眠质量指数 (PSQI) 用于在入院时对患者进行评估。 根据MEQ评分将患者分为早型(早睡早醒)、中型(一般型)和晚型(晚睡晚醒)。 通过比较三个时间类型组患者的基线数据来评估抑郁症患者的时间类型紊乱。 所有患者均接受相同的抗抑郁药物治疗 12 周。 在治疗后 2、4、8 和 12 周评估 HAMD-17、HAMA、SHAPS、MFI-20、PSQI 和 MEQ。 通过比较治疗前后的评分来评估不同类型抑郁症的治疗效果。 为了分析时间型对抑郁症治疗效果的影响,计算并评估各组在每个时间点的抑郁症缓解率。 研究过程中,可针对药物引起的不良反应进行相应处理。 对于入组前用于治疗原有躯体疾病的药物,可继续联合使用。 但研究期间不允许联合使用抗抑郁药、抗焦虑药、抗精神病药、心境稳定剂、甲状腺素等,也不允许联合使用其他全身心理治疗、电惊厥治疗或其他物理治疗。 根据患者病情,可短期联合使用小剂量苯二氮卓类药物或唑吡坦,但不要超过1周,以免干扰患者固有节律的观察和分析。
研究方法
精神状态量表由各中心2名具有中级以上职称的医生进行,在不知道分组的情况下对每位患者进行交叉盲法评估。
MEQ 通常用于评估睡眠类型。 本次调查问卷共有19个项目。 每个项目的评分范围为0至6分,总分为16至86分。根据这些分数,将个体分为早期型(59-86分)、中期型(42-58分)、 或晚期类型(分数 16-41)。
SHAPS是一种愉悦体验的衡量标准,由14个项目组成,涵盖兴趣/娱乐、社交、感官体验和饮食,要求受试者分别对列出的项目打1-4分,量表的总分是14-56。 总分越高,快感缺乏程度越严重。
MFI-20包括一般疲劳、身体疲劳、活动减少、积极性减少和精神疲劳五个维度,分值范围为20至100,分数越高,疲劳程度越高。
PSQI 用于评估受试者的睡眠质量。 PSQI由19个自评项目和5个其他评分项目组成,共有7个因素:睡眠质量、睡眠时间、睡眠时间、睡眠效率、睡眠障碍、安眠药物和日间功能障碍。 各因素得分范围为0~3分,总分范围为0~21分,其中7分为睡眠质量的分界值。 分数越高,睡眠质量越差。
HAMA 用于评估焦虑症状的严重程度。 Hama有14个项目,采用0-4的五级评分:(0)无症状,(1)轻度,(2)中度,(3)重度,(4)极重度。 总分≥29分表示严重焦虑; 总分≥21表示明确焦虑; 总分≥14分,明确焦虑; 总分≥7分表示可能存在焦虑; 总分<7表示没有焦虑症状。
HAMD-17 是包含 17 个项目的替换量表。 每题得分为0-2或0-4,总分为0-52分。 总分越高,抑郁程度越严重。 0-7分表示无抑郁症,8-17分表示轻度抑郁症,18-24分表示中度抑郁症,25-52分表示重度抑郁症。
结果衡量
在基线以及第 2、4、8 和 12 周结束时评估 HAMD-17 和 HAMA,并评估 SHAPS、MFI-20、MEQ 和 PSQI。 治疗期间记录主诉和不良反应,并采用治疗突发症状量表(TESS)进行评估。
有效缓解率定义为治疗前后HAMD-17总分下降率>50%,临床治愈定义为HAMD-17总分≤7分。
统计分析
采用SPSS 22.0软件进行数据处理。 计量资料采用均数±标准差正态分布,组间差异比较采用单因素方差分析。 对于分类变量或计数数据,使用频率(百分比),并使用卡方(X2)检验或费舍尔精确检验来比较分类变量。 检验水平α为0.05。 P<0.05表示差异有统计学意义。
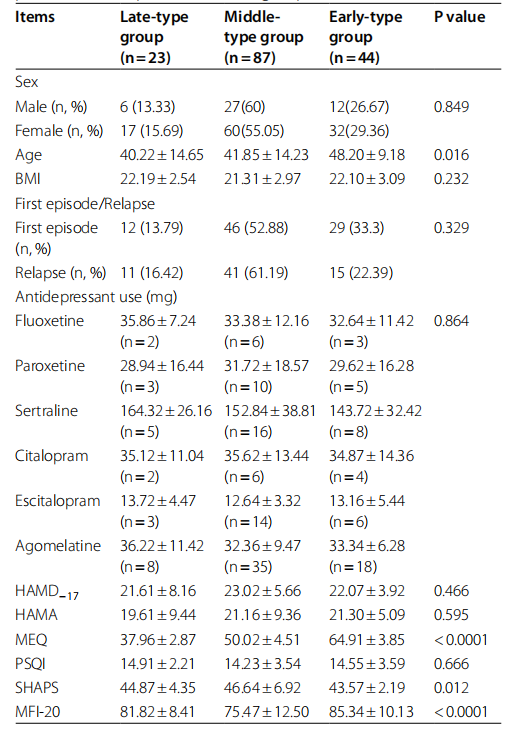
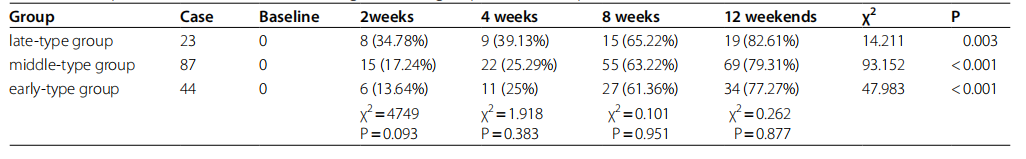
表1 各组抑郁症患者的基线人口统计数据和临床评估
结果
各组患者基线特征
在纳入的 180 名抑郁症患者中,26 名(14.45%)因数据丢失或不完整而未纳入分析,最终纳入 154 名(85.55%)患者,其中男性 45 名,女性 109 名。 根据MEQ评分,将154例患者分为3组,晚型组23例(14.93%),中间型组87例(56.5%),早型组44例(28.57%) 。 各组患者的基线特征如表1所示。基线时,早期型抑郁症患者的年龄显着高于中期型和晚期型抑郁症患者(p<0.05),表明年龄 可能会影响患者的时间型。 早期抑郁组的 Shaps 和 MFI-20 总分显着高于晚期抑郁组和中期抑郁组(p<0.05),这表明快乐丧失和疲劳程度可能受抑郁症影响较大。 计时型。 此外,三组间睡眠质量、焦虑和抑郁评分无显着差异(p>0.05),性别、BMI、复发和抗抑郁药物使用情况也无显着差异(p>0.05)。
分析各组抑郁症患者核心症状及生物节律的变化
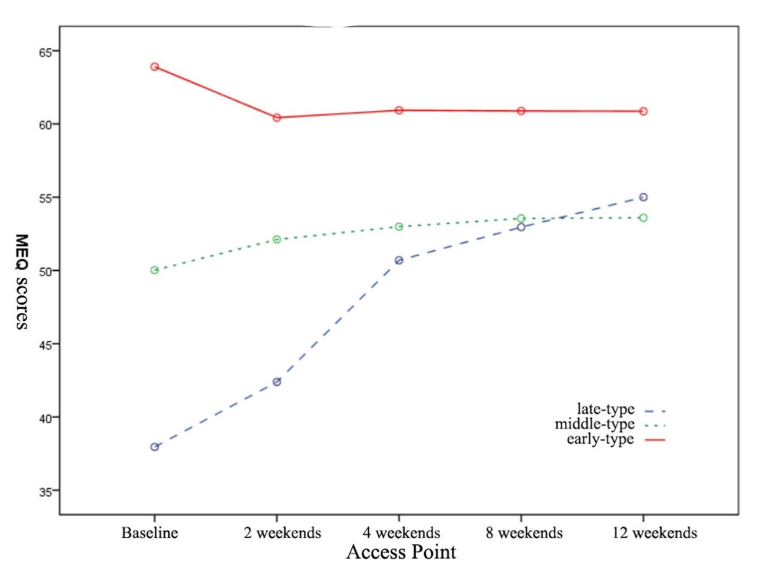
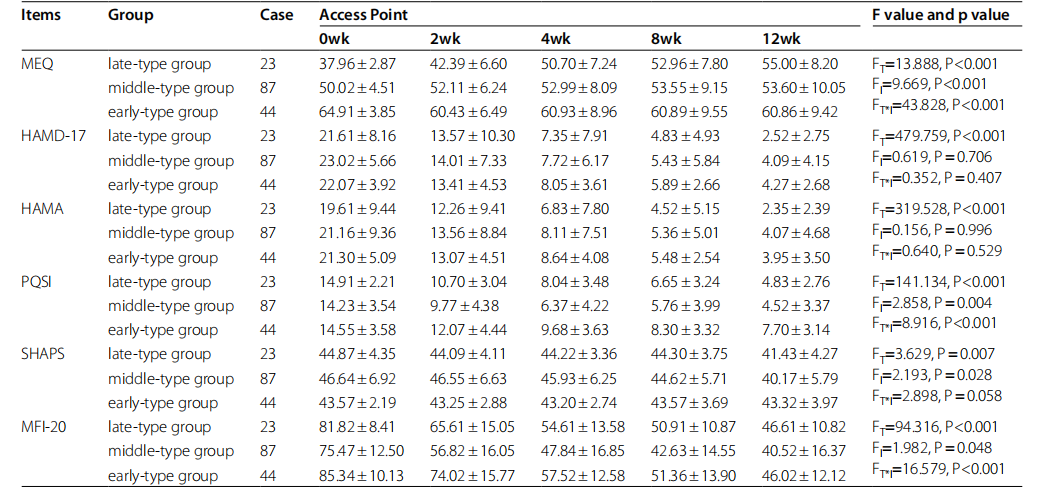
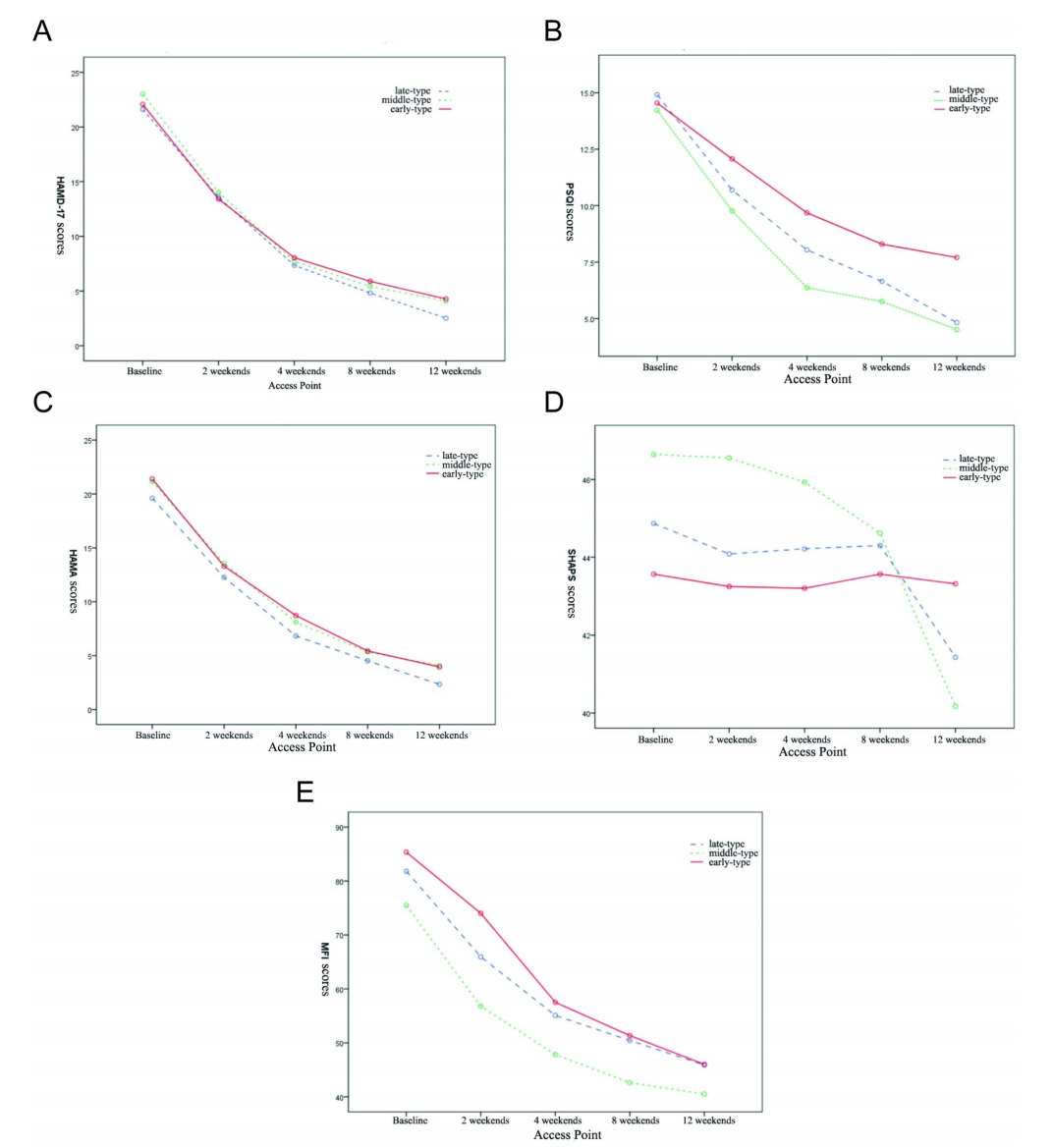
三组MEQ得分呈现出不同的变化趋势。 早型组MEQ评分呈下降趋势,中型组MEQ评分上升相对缓慢,晚型组则呈现显着上升趋势(图1)。 在12周的抗抑郁治疗期间,三组的HAMD-17、PSQI、HAMA、SHAPS和MFI-20评分均有所下降,各组的时间效应均显着(p<0.01)(表2;图2A) -E)。 除HAMD-17和HAMA外,三组之间均存在显着差异(p<0.05)。 此外,除HAMD-17和HAMA外,三组中其他量表的评分在治疗时间和不同时间类型之间存在交互作用(p<0.001,图2B、D和E),这表明治疗时间的时间效应 抗抑郁治疗因时间依赖性患者群体而异(表 2)。
研究结束时三组抑郁症状缓解率
治疗前后HAMD-17总分有效缓解率均大于50%,计算HAMD-17总分≤7分的临床治愈率。 结果如表3所示,在抗抑郁治疗期间,所有三组抑郁症状的缓解率依次升高(p<0.05或p<0.001)。 研究期间迟发性抑郁症的缓解率高于其他两组,但三组间缓解率无显着性差异(p>0.05)。
图1 不同类型抑郁症患者不同就诊点MEQ评分变化
表2 各组抑郁相关量表评分变化
FT:不同时间点差异显着性检验
Fl:三组间差异显着性检验
FT*l:不同尺度、不同时间类型之间交互显着性检验
图2 A.不同类型抑郁症患者不同就诊点HAMD-17评分的变化; B.不同类型抑郁症患者不同就诊点PSQI评分变化; C. 抑郁症患者不同就诊时间点的HAMA评分; D.不同类型抑郁症患者不同就诊点SHAPS评分的变化; E. 不同类型抑郁症患者不同就诊点MFI评分的变化
表3 三组抗抑郁治疗后缓解率比较
讨论
抑郁症患者睡眠时间型的变化已成为探讨抑郁症发生、发展的新视角。 这项针对中国人群的多中心研究为睡眠时间型与抗抑郁治疗疗效之间的关系提供了进一步的证据。
既往调查显示,在30~50岁的一般人群中,晚型、中型和早型的检出率分别为5.6%、44.6%和49.8%。 在我们的研究中,纳入分析的抑郁症患者中有14.93%、56.5%和28.57%在基线时发现有这些时间模式,表明与正常人群相比,抑郁症患者有明显的昼夜节律异常症状。 许多非临床样本显示,夜型与抑郁症状呈正相关,对抑郁症状和抑郁症有正向预测作用,而晨型则相反。De Souza和Hidalgo发现,工作日和休息日(往往是夜间)睡眠中点越晚,抑郁症状越严重,且睡眠中点晚对轻度抑郁症状有正向预测作用(BDI≥ 10)。 Merikanto 等人的逻辑回归分析。 结果表明,晚发型抑郁症的诊断、抗抑郁药物的使用和抑郁症状显着高于中发型和早发型。 在对临床样本的研究中也显示,夜型对抑郁症有显着的阳性预测作用。
有趣的是,在本研究中,PSQI、Hama 和 Hamd-17 的总分在不同时间类型之间没有显着差异。 早期型患者的MFI-20总分较高,而中期型患者的Shaps总分较高,即睡眠质量、焦虑症状和抑郁症状的严重程度相似。 节律障碍,但不同时型患者不同症状维度的严重程度可能不同。 这可能是由于受试者、测量工具的差异以及睡眠时长因素结构划分的不同,对睡眠时长与抑郁的关系产生了影响。 例如,古泽等人。 日本轮班工人使用抑郁自评量表(SDS)进行逻辑回归分析后发现,中间型出现抑郁状态(SDS≥45)的风险比早期型高1.67倍 ; 晚发性抑郁症的发生率没有显着差异(OR=3,p=0.074),这可能是由于晚发性抑郁症的数量较少(N=20,2.3%)。
在为期12周的研究过程中,我们研究中不同类型抑郁症患者的MEQ总分逐渐上升。 但除此之外,HAMD-17、HAMA、SHAPS、MFI-20、PSQI总分依次下降,且各组间时间效应显着(p<0.01),常见伴随症状有焦虑、失眠、心律失常等 也可以通过治疗来改善,这在过去已有报道。 但三组之间不同量表的变化趋势不同,大致可分为三种类型:
- 1.研究期间HAMD-17和Hama总分有所提高,变化趋势相同; 在每个访问点,三组之间没有显着差异。
- 2.疲劳和睡眠质量方面,研究期间MFI-20和PSQI总分均有所改善(p<0.01),变化趋势基本一致,但各访视点三组间均存在显着差异, 症状严重程度为早期型>晚期型>中期型,提示早期型患者可能出现早醒、低动力症状。
- 3.三组间Shaps和MEQ在快感丧失和节律紊乱方面存在显着差异,其中Meq随着时间的推移表现出最明显的分化趋势,早期型患者MEQ评分在2周内下降,此后趋于平稳 ,而晚期型患者的MEQ评分在整个研究期间呈现持续增加的趋势并维持到研究结束,而中期抑郁患者的MEQ评分在研究期间没有显着变化。 SHAPS评分总体变化缓慢,表明快感缺乏症状的改善明显滞后于其他症状的缓解。
中、晚期快感缺失患者在治疗第8周后表现出明显改善,然而,早发性抑郁症患者的快感丧失在整个研究过程中并没有明显改善,甚至在研究结束时也常见残留。 建议基线时患有早发性抑郁症的患者可能有快感缺乏的残留症状。
临床样本研究表明,晚发型抗抑郁药预后较差,与早发型和中发型患者相比,晚发型患者干预后抑郁评分较低。 Chan 等人对 253 名重度抑郁症患者进行了一项纵向研究。 研究发现,6 年后未缓解的迟发性重度抑郁症的风险比非迟发性重度抑郁症高出 3 倍。 然而,Druiven 等人对抑郁症患者进行的一项后续研究。 发现睡眠时间并不能预测抑郁症的缓解或维持。 一致的是,在本研究中,不同类型的抑郁症患者在研究期间的每个访视点都表现出缓解率增加的趋势(p <0.01),但是,每个访视点的三种类型的时间型之间没有显着差异 (p>0.05),提示不同的时间型对抑郁症状的缓解率没有显着影响。
这项研究存在一些局限性。 首先,本研究通过自报问卷总分或睡眠中点来测量睡眠时间类型,本质上将睡眠时间类型视为单维结构,而睡眠时间类型可能是由不同成分组成的多维结构。
其次,目前的研究仍集中在睡眠时长与抑郁的关系上,对两者关系的内在机制研究较少,未来的研究将丰富睡眠时长与抑郁关系的内在机制。 第三,本研究关于睡眠模式与抑郁症的关系以观察性研究为主,相关的干预性研究还较少,未来将加强干预性的实证研究。
结论
抗抑郁治疗过程中,睡眠时间型在抑郁症状维度对疲劳、愉悦感丧失和睡眠质量影响较大,但对抑郁缓解率影响不显着。 加强抑郁症患者生物钟型的调节对于抑郁症的治疗可能很重要。
References:
- Pathogenetic mechanisms of depressive states:https://pubmed.ncbi.nlm.nih.gov/6858512/
- How Does Depression Affect the Brain?:https://www.healthline.com/health/depression-physical-effects-on-the-brain
- Bacterial Metabolites of Human Gut Microbiota Correlating with Depression:https://pubmed.ncbi.nlm.nih.gov/33287416/
- The mesolimbic dopamine reward circuit in depression:https://pubmed.ncbi.nlm.nih.gov/16566899/
- Metabolic engineering in the biotechnological production of organic acids in the tricarboxylic acid cycle of microorganisms: Advances and prospects: https://pubmed.ncbi.nlm.nih.gov/25902192/
- Relationship of neurotransmitters to the symptoms of major depressive disorder:https://pubmed.ncbi.nlm.nih.gov/18494537/
- Atypical Neurotransmitters and the Neurobiology of Depression:https://pubmed.ncbi.nlm.nih.gov/26350337/
- The interaction between gamma-aminobutyric acid and other related neurotransmitters in depression:https://pubmed.ncbi.nlm.nih.gov/25219270/
- Differences in excitatory and inhibitory neurotransmitter levels between depressed patients and healthy controls: A systematic review and meta-analysis:https://pubmed.ncbi.nlm.nih.gov/30144668/
- The methylation, neurotransmitter, and antioxidant connections between folate and depression:https://pubmed.ncbi.nlm.nih.gov/18950248/
- Depression: the case for a monoamine deficiency:https://pubmed.ncbi.nlm.nih.gov/10775018/
- The endocannabinoid system: physiology and pharmacology:https://pubmed.ncbi.nlm.nih.gov/15550444/
- Novel targets for ameliorating energy metabolism disorders in depression through stable isotope-resolved metabolomics:https://pubmed.ncbi.nlm.nih.gov/35640666/
- The identification of metabolic disturbances in the prefrontal cortex of the chronic restraint stress rat model of depression:https://pubmed.ncbi.nlm.nih.gov/26947756/
- Urinary metabonomic study on biochemical changes in chronic unpredictable mild stress model of depression:https://pubmed.ncbi.nlm.nih.gov/19913000/
- Leptin Dysregulation Is Specifically Associated With Major Depression With Atypical Features: Evidence for a Mechanism Connecting Obesity and Depression:https://pubmed.ncbi.nlm.nih.gov/26742925/
- Depression and obesity: evidence of shared biological mechanisms:https://pubmed.ncbi.nlm.nih.gov/29453413/
- Physical activity and energy expenditure during depressive episodes of major depression:https://pubmed.ncbi.nlm.nih.gov/25532078/
- Energy metabolism in major depressive disorder: Recent advances from omics technologies and imaging:https://pubmed.ncbi.nlm.nih.gov/34225015/
- Beta-ketothiolase deficiency: An unusual cause of recurrent ketoacidosis:https://pubmed.ncbi.nlm.nih.gov/29624230/
- Mitochondrial respiration in peripheral blood mononuclear cells correlates with depressive subsymptoms and severity of major depression:https://pubmed.ncbi.nlm.nih.gov/26126180/
- The mitochondrial respiratory chain:https://pubmed.ncbi.nlm.nih.gov/20533897/
- Mitochondrial Respiratory Chain Complexes:https://pubmed.ncbi.nlm.nih.gov/29464561/
- The assembly, regulation and function of the mitochondrial respiratory chain:https://pubmed.ncbi.nlm.nih.gov/34621061/
- CPK Isoenzymes Test:https://www.healthline.com/health/cpk-isoenzymes-test
- Weight gain in Major Depressive Disorder: Linking appetite and disordered eating to leptin and ghrelin:https://pubmed.ncbi.nlm.nih.gov/30878306/
- Problematic eating behaviours, changes in appetite, and weight gain in Major Depressive Disorder: The role of leptin:https://pubmed.ncbi.nlm.nih.gov/30071417/
- Overeating and food addiction in Major Depressive Disorder: Links to peripheral dopamine:https://pubmed.ncbi.nlm.nih.gov/31926176/
- Sleep disturbances in relation to fatigue in major depression:https://pubmed.ncbi.nlm.nih.gov/19073291/
- Excessive daytime sleepiness and fatigue in depressed patients and therapeutic response of a sedating antidepressant: https://pubmed.ncbi.nlm.nih.gov/21616541/
- Symptoms of fatigue and sleepiness in major depressive disorder:https://pubmed.ncbi.nlm.nih.gov/16848671/
- Fatigue is associated with depression independent of excessive daytime sleepiness in the general population:https://pubmed.ncbi.nlm.nih.gov/34292460/
- Fatigue and Depression: Are They Connected?:https://www.healthline.com/health/depression/fatigue
- What Causes Muscle Fatigue?:https://www.healthline.com/health/muscle-fatigue
- Handgrip strength and depression among 34,129 adults aged 50 years and older in six low- and middle-income countries:https://pubmed.ncbi.nlm.nih.gov/30273883/
- Central and peripheral fatigue: exemplified by multiple sclerosis and myasthenia gravis:https://pubmed.ncbi.nlm.nih.gov/20656621/
- Paying attention to attention in depression:https://pubmed.ncbi.nlm.nih.gov/31699968/
- Description and measurement of concentration problems in depressed patients:https://pubmed.ncbi.nlm.nih.gov/4023135/
- Description and measurement of concentration problems in depressed patients:https://pubmed.ncbi.nlm.nih.gov/4023135/
- Associations between phenomenal and objective aspects of concentration problems in depressed patients:https://pubmed.ncbi.nlm.nih.gov/3395793/
- Impact of depression heterogeneity on attention: an auditory oddball event related potential study:https://pubmed.ncbi.nlm.nih.gov/19740547/
- Anhedonia in Depressive Disorder: A Narrative Review:https://pubmed.ncbi.nlm.nih.gov/32668436/
- Anhedonia in Depression and Schizophrenia: Brain Reward and Aversion Circuits:https://pubmed.ncbi.nlm.nih.gov/35836582/
- Does anhedonia correlate with depression severity in chronic depression?:https://pubmed.ncbi.nlm.nih.gov/9298317/
- Anhedonia in depressed patients on treatment with selective serotonin reuptake inhibitor anti-depressant—A two-centered study in Malaysia:https://pubmed.ncbi.nlm.nih.gov/25874350/
- Pharmacological interventions targeting anhedonia in patients with major depressive disorder: A systematic review:https://pubmed.ncbi.nlm.nih.gov/30611836/
- What You Need to Know About Barbiturates:https://www.healthline.com/health/barbiturates
- How Does Depression Affect the Brain?:https://www.healthline.com/health/depression-physical-effects-on-the-brain
- New insights into the neurobiological mechanisms of major depressive disorders:https://pubmed.ncbi.nlm.nih.gov/25772946/
- Hippocampal neuroplasticity in major depressive disorder:https://pubmed.ncbi.nlm.nih.gov/25934030/
- Brain aging in major depressive disorder: results from the ENIGMA major depressive disorder working group:https://pubmed.ncbi.nlm.nih.gov/32424236/
- The association between clinical and biological characteristics of depression and structural brain alterations:https://pubmed.ncbi.nlm.nih.gov/35760189/
- Sub-threshold depressive symptoms and brain structure: A magnetic resonance imaging study within the Whitehall II cohort:https://pubmed.ncbi.nlm.nih.gov/27372409/
- Longitudinal MR study of brain structure and hippocampus volume in major depressive disorder:https://pubmed.ncbi.nlm.nih.gov/21219263/
- Features of the gut microbiota in ulcerative colitis patients with depression: A pilot study:https://pubmed.ncbi.nlm.nih.gov/33607855/
- Gut microbiota and neuropsychiatric disorders: Implications for neuroendocrine-immune regulation:https://pubmed.ncbi.nlm.nih.gov/34543739/
- Associations between disordered gut microbiota and changes of neurotransmitters and short-chain fatty acids in depressed mice:https://pubmed.ncbi.nlm.nih.gov/33067412/
- Gut Bacteria and Neurotransmitters:https://pubmed.ncbi.nlm.nih.gov/36144440/
- A narrative review of relationship between gut microbiota and neuropsychiatric disorders: mechanisms and clinical application of probiotics and prebiotics:https://pubmed.ncbi.nlm.nih.gov/33549028/
- Health Benefits and Side Effects of Short-Chain Fatty Acids:https://pubmed.ncbi.nlm.nih.gov/36140990/
- The role of short-chain fatty acids in health and disease:https://pubmed.ncbi.nlm.nih.gov/24388214/
- Short-Chain Fatty Acids and Their Association with Signalling Pathways in Inflammation, Glucose and Lipid Metabolism:https://pubmed.ncbi.nlm.nih.gov/32887215/
- Anhedonia and the brain reward circuitry in depression:https://pubmed.ncbi.nlm.nih.gov/26525751/
- The mesolimbic dopamine reward circuit in depression:https://pubmed.ncbi.nlm.nih.gov/16566899/
- Role of the Brain’s Reward Circuitry in Depression: Transcriptional Mechanisms:https://pubmed.ncbi.nlm.nih.gov/26472529/
- Behavioral functions of the mesolimbic dopaminergic system: an affective neuroethological perspective:https://pubmed.ncbi.nlm.nih.gov/17905440/
- The control of sleep and wakefulness by mesolimbic dopamine systems:https://pubmed.ncbi.nlm.nih.gov/28434991/
- Insulin actions in the mesolimbic dopamine system:https://pubmed.ncbi.nlm.nih.gov/31279911/
- The mesolimbic dopamine reward circuit in depression:https://pubmed.ncbi.nlm.nih.gov/16566899/
- The Mesolimbic Dopamine System in Chronic Pain and Associated Affective Comorbidities:https://pubmed.ncbi.nlm.nih.gov/31806085/
- Causes of Depression:https://www.healthline.com/health/depression/causes
- Can You Inherit a Mental Illness?:https://www.healthline.com/health/are-mental-illness-genetic
- Genetic epidemiology of major depression: review and meta-analysis:https://pubmed.ncbi.nlm.nih.gov/11007705/
- The Role of Sex in Genetic Association Studies of Depression:https://pubmed.ncbi.nlm.nih.gov/36741030/
- The Role of Genetics in the Development and Pharmacotherapy of Depression and Its Impact on Drug Discovery:https://pubmed.ncbi.nlm.nih.gov/36769269/
- Biological aspects of depression:https://pubmed.ncbi.nlm.nih.gov/7914394/
- Biological mechanisms in the relationship between depression and heart disease:https://pubmed.ncbi.nlm.nih.gov/12667498/
- Pathophysiological relationships between heart failure and depression and anxiety:https://pubmed.ncbi.nlm.nih.gov/24692463/
- The Link between Depression and Chronic Pain: Neural Mechanisms in the Brain:https://pubmed.ncbi.nlm.nih.gov/28706741/
- A review of lifestyle factors that contribute to important pathways associated with major depression: diet, sleep and exercise:https://pubmed.ncbi.nlm.nih.gov/23415826/
- Physical activity and depression: Towards understanding the antidepressant mechanisms of physical activity:https://pubmed.ncbi.nlm.nih.gov/31586447/
- The biology of depression in cancer and the relationship between depression and cancer progression:https://pubmed.ncbi.nlm.nih.gov/24716498/
- Effects of chronotype on antidepressant treatment and symptoms in patients with depression: a multicenter, parallel, controlled study:https://pubmed.ncbi.nlm.nih.gov/37081401/